Por Dra. Cecilia González Caro
Resumen ejecutivo
El virus respiratorio sincicial humano (VRS) es el principal agente productor de infección respiratoria a nivel mundial, tiene una distribución universal y un marcado carácter estacional, la incidencia máxima se alcanza en los meses de invierno. Las infecciones por VRS del subgrupo A tienen una mayor incidencia y mayor transmisibilidad que las del grupo B, aunque ambos son detectables durante la misma temporada epidémica (1).
El VRS es uno de virus que con mayor frecuencia infecta a los niños en todo el mundo y cada vez más se reconoce como un patógeno importante en los adultos mayores (2).
La presentación clínica más común de la infección por VRS es una enfermedad de las vías respiratorias superiores, pero en lactantes menores se presenta frecuentemente como bronquiolitis, una enfermedad de las vías respiratorias inferiores con obstrucción de las vías pequeñas, y que puede progresar a neumonía, insuficiencia respiratoria, apnea y muerte.
Epidemiología
El VRS es la principal causa de infección del tracto respiratorio inferior (ITRI) en el mundo, capaz de causar grandes epidemias de bronquiolitis y neumonías afectando todas las edades, pero especialmente a los lactantes, tanto en países en desarrollo como en los desarrollados.
Más del 60% de todos los niños son infectados por VRS en su primer año de vida y casi todos se infectan al menos una vez en los 2 años después del nacimiento (3).
A nivel global se estima que cada año el VRS produce, en la población de menores de 5 años, 33 millones de ITRI, 3,2 millones de hospitalizaciones y unos 49 mil fallecimientos. El 99% en países con menor Índice de Desarrollo Humano, siendo las hospitalizaciones y muertes más frecuentes en los menores de 6 meses de edad. Es la 2ª causa de mortalidad de origen infeccioso en lactantes de 1 a 12 meses, solo por detrás de la malaria.
El VRS constituye uno de los principales motivos de consulta en atención primaria y urgencias pediátricas, además es la principal causa de hospitalización en los periodos de máxima incidencia. Prácticamente el 70 % de las hospitalizaciones por bronquiolitis se deben al VRS. Cada vez más se describe su impacto en la población adulta, especialmente en mayores de 65 años, en la que el VRS es responsable de aproximadamente 1,5 millones de episodios de infección respiratoria de las vías bajas (4).
Clasificación
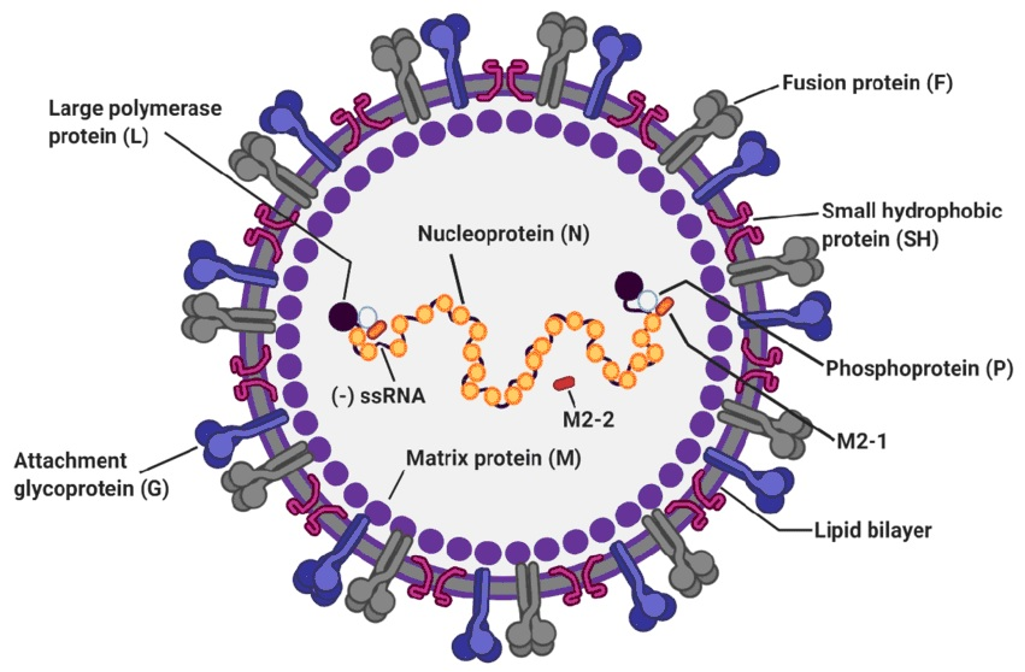
Fuente: Jung HE. et al. Viruses. 2020 Jan 15;12(1):102.
El VRS es un virus envuelto, con un genoma de ácido ribonucleico (ARN) monocatenario de sentido negativo lineal, pertenece al género Paramixoviridae, familia Pneumoviridae. Tiene dos grupos antigénicos principales de cepas, A y B, y múltiples genotipos dentro de los dos grupos.
La estructura del VRS consiste en un genoma viral de ARN, que contiene 10 genes que codifican 11 proteínas, 8 de ellas estructurales; una nucleocápside y una envoltura lipídica donde se anclan 3 proteínas de membrana: la glicoproteína G, la proteína de fusión F y la proteína SH (hidrofóbica). La proteína M de matriz no glicosilada está presente en la cara interna de la envoltura, las glicoproteínas forman homoligómeros separados que aparecen como picos superficiales cortos (11-16 nm). Hay además cuatro proteínas nucleocápside/polimerasa: la nucleoproteína N, la fosfoproteína P, el factor de transcripción M2-1, y la subunidad grande de polimerasa L.
Las únicas proteínas que inducen anticuerpos neutralizantes son la glucoproteína F y la glucoproteína G. La diana preferida para el desarrollo de vacunas, anticuerpos monoclonales y antivirales, es la proteína F, que juega un papel esencial en la entrada del virus a la célula huésped, está altamente conservada dentro y entre los subtipos A y B del VRS, y debido a sus 6 sitios antigénicos genera la producción de altas concentraciones de anticuerpos neutralizantes.
El VRS carece de actividad de neuraminidasa o hemaglutinina y se sabe que la proteína F es muy sialisada, presumiblemente debido a la falta de una neuraminidasa (5).
Fisiopatología
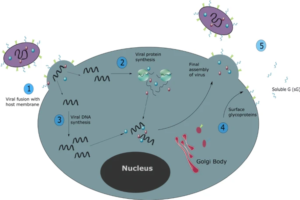
Fuente: Efstathiou, C. et al. Cell. Mol. Life Sci. 77, 5045–5058 (2020).
El VRS se propaga de persona a persona a través de gotitas respiratorias, el período de incubación después de la inoculación varía de 2 a 8 días, con un promedio de 4 a 6 días, que depende de factores del huésped, como la edad y si se trata de la primoinfección con RSV. El período de excreción es de una semana, aunque se han documentado períodos más largos, especialmente en niños pequeños y pacientes inmunocomprometidos. Los individuos con VRS asintomáticos no reconocidos juegan un papel importante en la transmisión del virus dentro del hogar y en la comunidad (6).
VRS puede sobrevivir en fómites (juguetes, pañuelos de papel y camas) durante varias horas y en las manos hasta 25 minutos (7).
Después de la inoculación en la mucosa nasofaríngea o conjuntival, el virus se propaga rápidamente al tracto respiratorio, donde se dirige a su medio de crecimiento preferido: las células epiteliales ciliadas apicales. Allí se une a los receptores celulares usando la glicoproteína G, luego la glicoproteína de fusión F que le permite fusionarse con las membranas de la célula huésped e insertar su nucleocápside en ella para comenzar su replicación intracelular.
La respuesta inmunitaria inflamatoria del huésped, incluye la activación de células T humorales y citotóxicas, la combinación de la citotoxicidad viral y la respuesta citotóxica del huésped causan necrosis de las células epiteliales respiratorias, lo que conduce a la obstrucción de las vías respiratorias pequeñas y taponamiento por moco y desechos celulares. En los casos más graves también se puede producir obstrucción alveolar. Los efectos posteriores incluyen disfunción ciliar con disminución de la eliminación del moco, edema de las vías respiratorias y disminución de la distensibilidad pulmonar (8).
Patogenia
La patogenia del VRS es compleja y variable, la enfermedad puede abarcar una amplia gama de manifestaciones agudas de las vías respiratorias, desde rinitis leve, en un extremo hasta bronquiolitis y neumonía en el otro. La heterogeneidad de la enfermedad puede incluir una asociación entre la enfermedad grave y la posterior hiperreactividad de las vías respiratorias durante la infancia y quizás más allá, neumonía de células gigantes en pacientes inmunocomprometidos, e infección en adultos mayores institucionalizados que pueden llevar a la exacerbación de condiciones subyacentes y un exceso de mortalidad.
Factores del huésped juegan un papel importante en la heterogeneidad de la enfermedad: estos incluyen nacimiento prematuro, los extremos de la vida presentan mayor susceptibilidad, bajos títulos de anticuerpos séricos, condiciones subyacentes tales como enfermedad pulmonar o cardíaca crónica o inmunosupresión, vías respiratorias estrechas o reactivas y otros factores del huésped que aún falta describir completamente.
Clínica
Las manifestaciones clínicas del VRS varían de acuerdo con la edad y van desde síntomas similares a una gripe leve hasta infecciones respiratorias graves, incluidas bronquiolitis y neumonía que pueden requerir tratamiento intensivo y ventilación mecánica (9).
La sintomatología de una infección por el VRS generalmente comienza después de un período de incubación de 4 a 6 días, con síntomas gripales y manifestaciones que afectan las vías respiratorias superiores, como congestión nasal, rinorrea y tos. En recién nacidos y lactantes menores de 2 años edad, el cuadro clínico puede evolucionar a bronquiolitis, que es una inflamación de las vías respiratorias pequeñas asociada con tos y disnea; los niños más pequeños pueden presentar fiebre, dificultad para alimentarse e irritabilidad (10). En los recién nacidos y especialmente en los lactantes, la infección por VRS puede estar asociada con otras manifestaciones clínicas, como neumonía y sibilancias (11).
Un estudio escocés, con más de 740.000 recién nacidos seguidos hasta los 18 años, reveló que los hospitalizados por una infección por VRS durante los primeros 2 años de vida tenían un riesgo tres veces mayor de hospitalización por asma, y mayor uso de fármacos antiasmáticos en comparación con los controles (12). No está claro si esta asociación se debe a daño pulmonar persistente causado por VRS o si una afección pulmonar subyacente predispone a los niños a la infección por VRS y a la aparición de otros trastornos respiratorios; así, una de las ventajas de la estrategia para prevenir las infecciones por VRS en el recién nacido y lactantes sería evitar la morbilidad respiratoria crónica (13).
Prevención
En la actualidad no se cuenta con un tratamiento específico y efectivo contra la enfermedad causada por el VRS. Hay dos anticuerpos monoclonales para la prevención pasiva de la enfermedad por VRS aprobados: Palivizumab (Synagys®, 1998) y recientemente el Nirsevimab (Beyfortus®, EMA el 4 de noviembre de 2022).
Palivizumab es un anticuerpo monoclonal IgG1 humanizado producido por tecnología de ADN recombinante en células de mielomas de ratón, que contiene un 95% de secuencia genética idéntica a la humana, y el 5% restante de origen murino. Se une a la proteína F del VRS, inhibiendo la fusión celular. Tiene una vida media de 20 días.
Nirsevimab es un anticuerpo monoclonal humano de inmunoglobulina G1 kappa producido en células de ovario de hámster chino mediante tecnología de ADN recombinante, con una sustitución triple de aminoácidos (YTE) en la región Fc que extiende la vida media en suero (85 y 117 días). Actúa uniéndose al sitio antigénico Ø de la proteína pre-F bloqueando la fusión celular.
A pesar de más de 50 años de trabajos en el desarrollo de vacunas contra VRS, solo recientemente, marzo 2023, la FDA ha recomendado la autorización de la comercialización de la vacuna Abrysvo® de Pfizer. También en marzo del 2023 el grupo asesor en inmunizaciones de la Food and Drug Administration de los Estados Unidos (VRBPAC) dio su respaldo a la vacuna Arexvy® de GlaxoSmithKline frente a la enfermedad ocasionada por VRS para su uso en las personas de sesenta o más años. El día 3 de mayo, Arexvy® fue aprobada por la FDA convirtiéndose en la primera vacuna contra el VRS (14).
Recomendaciones Palivizumab
En 1998, el Palivizumab fue aprobado para la prevención de infecciones por VRS en poblaciones específicas de pacientes (Tabla 1).
Tabla 1: Indicaciones para uso Food & Drugs Administration
- RNPT menor o igual a 28 semanas y nacido antes de 12 meses de última temporada VRS
- RNPT 29 a 32 semanas y nacido antes de 6 meses de última temporada VRS
- RNPT de 32 a 35 semanas, nacido antes de 6 meses de última temporada VRS y que tiene 2 o mas factores de riesgo adicional
- Lactante menor de 2 años con Enfermedad Pulmonar Crónica que requiere tratamiento (O2, broncodilatadores, diuréticos, corticoides) en los últimos 6 meses antes de la temporada de VRS
- Lactante menor de 2 años con enfermedad cardiaca congénita con compromiso hemodinámico significativo
Adaptado de Product Information. Synagis (palivizumab) Gaithersburg, MD: MedImmune; October 2007 (15).
En general, el uso actual de Palivizumab está regulado en los diferentes países por recomendaciones que se basan en la evidencia de la literatura y la opinión de las sociedades científicas de neonatología y de pediatría. En términos generales, estas recomendaciones incluyen la profilaxis en el primer año de vida en niños con: prematuridad menor o igual a 29 semanas de edad gestacional, enfermedad pulmonar crónica del prematuro, cardiopatía congénita o trastornos neuromusculares (16).
Tabla 2: Indicaciones para uso American Academy of Pediatrics (AAP)
- En el primer año de vida, se recomienda para los RN antes de las 29 semanas de gestación.
- En el primer año de vida, se recomienda para los RN <32 semanas, con EPC (requerimiento de O2 >21% durante al menos 28 días después del nacimiento).
- En el primer año de vida a ciertos RN con cardiopatía hemodinámicamente significativa.
- Administrar hasta un máximo de 5 dosis de palivizumab (15 mg/kg por dosis/por mes) durante la temporada de RSV a los RN que califican para la profilaxis en el primer año de vida.
- En el segundo año de vida, a los niños que requirieron al menos 28 días de oxígeno suplementario después del nacimiento y que continúan requiriendo intervención médica (oxígeno suplementario, o diuréticos).
- Durante el primer año de vida pueden ser considerados los niños con anomalías pulmonares o enfermedades neuromusculares que afectan la capacidad de eliminar secreciones de las vías respiratorias superiores.
- Pueden ser considerados los niños menores de 24 meses que están profundamente inmunocomprometidos durante la temporada de RSV.
Adaptado de American Academy of Pediatrics: RSV Policy Statement —Updated Guidance for Palivizumab Prophylaxis Among Infants and Young Children at Increased Risk of Hospitalization for Respiratory Syncytial Virus Infection (17).
En agosto 2023, la AAP recomienda que todos los lactantes menores de 8 meses reciban el nuevo anticuerpo monoclonal nirsevimab para protegerlos del virus respiratorio sincitial (VSR), al tiempo que entrega orientaciones para continuar con el uso de palivizumab en la temporada 2023-24 (18).
Recomendaciones Nirsevimab
La indicación aprobada por la EMA es para la prevención de la enfermedad de las vías respiratorias inferiores producida por el Virus Respiratorio Sincitial (VRS) en neonatos y lactantes durante su primera temporada del VRS (19).
Se administra antes de que comience la temporada de VRS o en el momento del nacimiento en el caso de los lactantes nacidos durante la temporada de VRS. La dosis recomendada es de 50 mg para niños que pesen menos de 5 kg y de 100 mg para niños que pesen 5 kg o más por una sola vez.
Recomendaciones Abrysvo®
El grupo asesor en inmunizaciones de la Food and Drug Administration de los Estados Unidos (VRBPAC), ha recomendado la autorización de la comercialización de la vacuna Abrysvo® de Pfizer para la prevención de las infecciones respiratorias causadas por el VRS con la indicación de uso en los adultos de sesenta o más años (20).
Recomendaciones Arexvy®
Arexvy está aprobada para la prevención de la enfermedad de las vías respiratorias inferiores (EVRI) causada por el VRS en personas de 60 años o más. La seguridad y eficacia de Arexvy se basan en el análisis de la FDA de los datos de un estudio clínico aleatorizado en curso, controlado con placebo realizado en los Estados Unidos e internacionalmente en personas de 60 años o más (21).
Referencias
- Comité Asesor de Vacunas (CAV-AEP). Virus respiratorio sincitial. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; feb/2023. [consultado el 20/02/2023]. Disponible en: http://vacunasaep.org/documentos/manual/cap-33
- Jain H, Schweitzer JW, Justice NA. Respiratory Syncytial Virus Infection. [Updated 2022 Nov 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK459215/
- Azzari et al. Epidemiology and prevention of respiratory syncytial virus infections in children in Italy. Italian Journal of Pediatrics (2021) 47:198 https://doi.org/10.1186/s13052-021-01148-8
- Comité Asesor de Vacunas (CAV-AEP). Virus respiratorio sincitial. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; feb/2023. [consultado el 20/02/2023]. Disponible en: http://vacunasaep.org/documentos/manual/cap-33
- Comité Asesor de Vacunas (CAV-AEP). Virus respiratorio sincitial. Manual de inmunizaciones en línea de la AEP [Internet]. Madrid: AEP; feb/2023. [consultado el 20/02/2023]. Disponible en: http://vacunasaep.org/documentos/manual/cap-33
- Hall CB, Douglas RG, Jr., Geiman JM. Possible transmission by fomites of respiratory syncytial virus. J Infect Dis. 1980;141(1):98-102. Available at: https://academic.oup.com/jid/article-abstract/141/1/98/826973
- Ye S, Wang T. Laboratory epidemiology of respiratory viruses in a large children’s hospital: A STROBE-compliant article. Medicine (Baltimore). 2018 Jul;97(30):e11385
- Barbati F, Moriondo M, Pisano L, Calistri E, Lodi L, Ricci S, et al. Epidemiology of respiratory syncytial virus-related hospitalization over a 5-year period in Italy: evaluation of seasonality and age distribution before vaccine introduction. Vaccines (Basel). 2020;8(1):15. https://doi.org/10.3390/vaccines8010015
- Munywoki PK, Koech DC, Agoti CN, Bett A, Cane PA, Medley GF, et al. Frequent Asymptomatic Respiratory Syncytial Virus Infections During an Epidemic in a Rural Kenyan Household Cohort. J Infect Dis. 2015;212(11):1711-8. Available at: https://academic.oup.com/jid/article-abstract/212/11/1711/2911898
- Barr R, Green CA, Sande CJ, Drysdale SB. Respiratory syncytial virus: diagnosis, prevention and management. Ther Adv Infect Dis. 2019; 6:2049936119865798. Available at: https://journals.sagepub.com/doi/abs/10.1177/2049936119865798
- Takeyama A, Hashimoto K, Sato M, Sato T, Tomita Y, Maeda R, et al. Clinical and epidemiologic factors related to subsequent wheezing after virus induced lower respiratory tract infections in hospitalized pediatric patients younger than 3 years. Eur J Pediatr. 2014;173(7):959–66. https://doi.org/10.1007/s00431-014-2277-7
- Coutts J, Fullarton J, Morris C, Grubb E, Buchan S, Rodgers-Gray B, et al. Association between respiratory syncytial virus hospitalization in infancy and childhood asthma. Pediatr Pulmonol. 2020;55(5):1104–10. https://doi.org/10.1002/ppul.24676
- Driscoll AJ, Arshad SH, Bont L, Brunwasser SM, Cherian T, Englund JA, et al. Does respiratory syncytial virus lower respiratory illness in early life cause recurrent wheeze of early childhood and asthma? Critical review of the evidence and guidance for future studies from a World Health Organization-sponsored meeting. 2020;38(11):2435–48. https://doi.org/10.1016/j.vaccine.2020.01.020
- FDA approves first respiratory syncytial virus (RSV) vaccine [Internet]. FDA; 2013 [cited 2023 May 15]. Available from: https://www.fda.gov/news-events/press-announcements/fda-approves-first-respiratory-syncytial-virus-rsv-vaccine
- Product Information. Synagis (palivizumab) Gaithersburg, MD: MedImmune; October 2007.
- American Academy of Pediatrics Committee on Infectious Diseases and Bronchiolitis guidelines committee. Updated Guidance for Palivizumab Prophylaxis Among Infants and Young Children at Increased Risk of Hospitalization for Respiratory Syncytial Virus Infection. Pediatrics(2014) 134 (2): 415–420. https://doi.org/10.1542/peds.2014-1665
- American Academy of Pediatrics: RSV Policy Statement —Updated Guidance for Palivizumab Prophylaxis Among Infants and Young Children at Increased Risk of Hospitalization for Respiratory Syncytial Virus Infection. Pediatrics2014;134(2):415–420 Pediatrics (2014) 134 (6): 1221. https://doi.org/10.1542/peds.2014-2783
- American Academy of Pediatrics. AAP Recommendations for the Prevention of RSV Disease in Infants and Children [Internet]. 2022 [cited 2024, august 12]. Available from: https://publications.aap.org/redbook/resources/25379/
- Summary of Product Characteristics. [acceso: 10.04.2023] https://www.ema.europa.eu/en/medicines/human/EPAR/beyfortus
- Vaccines and Related Biological Products Advisory Committee Meeting February 28, 2023 FDA Briefing Document Respiratory Syncytial Virus Vaccine (Proposed Trade Name: Abrysvo) [acceso 10.04.2023] https://www.fda.gov/media/165623/download
- USA Food & drugs administration. ABRYSVO Summary Basis for Regulatory Action [acceso 12.08.2024] https://www.fda.gov/media/172126/download?attachment
Descarga PDF
Última actualización agosto 2024

